Ar quente sobe, certo? Logo é quente nas montanhas e frio no litoral...
Que o ar quando é aquecido se expande, todo mundo sabe. Que
ao se expandir ele se torna menos denso, também todo mundo sabe. Que ao se
tornar menos denso ele sobe, por causa do empuxo do ar externo, novamente todo
mundo sabe: assim que são feitos os balões. Logo, é mais quente nas montanhas –
para onde vai o ar aquecido – do que no litoral?
Em
situações normais o litoral é mais quente do que as montanhas. E isso, também,
todo mundo sabe. Parece, então, que está faltando alguma informação para
colocar as coisas em seus devidos lugares, o ar quente nas praias e o ar frio
nas montanhas.
Para
entender completamente o que acontece, precisaríamos estudar os complexos processos
físicos na atmosfera. Entretanto, podemos entender por que é frio nas montanhas
e quente no litoral, apesar do ar quente tender a subir sem precisar grandes
estudos de meteorologia.
A temperatura está relacionada à energia interna de um gás (e também de um líquido ou sólido). A energia interna, por
sua vez, está relacionada à velocidade média das moléculas do gás, ou seja, a
energia cinética dessas moléculas: quanto mais quente maior é a energia interna
e a velocidade média das moléculas.
Há
duas maneiras de alterar a energia cinética das moléculas de um gás, ou seja,
sua energia interna e sua temperatura. Uma delas é aquecê-lo ou esfriá-lo,
colocando-o em um ambiente a uma temperatura diferente; outra é fazer trabalho
sobre o gás ou deixar que ele faça trabalho contra alguma força externa. Veja:
se um gás faz trabalho contra uma força externa, o sistema sobre o qual o
trabalho é feito ganha energia; logo, o gás perde energia. Se
perde energia, ele esfria.
Quando enchemos um pneu de bicicleta, pressionamos o ar
dentro da bomba, fazendo trabalho sobre ele. Nós perdemos energia ao fazer
isso, e o gás dentro da bomba ganha energia e se aquece[i]. Podemos
perceber isso verificando o quão quente fica a bomba após algumas pressionadas.
Este é um exemplo mais ou menos trivial de que quando se faz trabalho sobre um
sistema ele se aquece.
O contrário também é verdade. Quando um gás a certa
temperatura se expande contra um agente que faça uma força sobre ele, ele se
esfria.
Resumo: se um gás se expande contra uma força externa, ele
se esfria; se é comprimido por uma força externa, se aquece.
Quando o gás que está pressurizado em um tubo de desodorante
(do tipo spray) sai, ele encontra-se inicialmente sob pressão
mais alta que a atmosfera. Com isso, se expande, até atingir a pressão
atmosférica. Ao se expandir, o gás faz um trabalho contra uma força externa que
o comprime, a força feita pelo restante do ar atmosférico. Ao fazer trabalho,
sua energia interna diminui e, com isso, sua temperatura também diminui.
O mesmo efeito ocorre com uma massa de ar que é empurrada de
uma região com maior pressão para uma região com menor pressão, por exemplo, ao
subir uma montanha. Nesse processo o ar se expande e se esfria. O nome técnico
que esse processo recebe é “expansão adiabática”, ou seja, expansão sem troca
de energia térmica com o ambiente. A figura é uma tentativa de ilustrar esse
fenômeno.
Conclusão: essa é a razão pela qual o ar é frio no alto das
montanhas e quente no litoral 
Na
verdade, não precisa haver montanhas para o ar subir e se esfriar. Em altitudes
até cerca de dez quilômetros há sempre movimentos horizontais e verticais do ar,
o que faz com que a temperatura decresça com a altitude mesmo que não haja
montanhas por perto.
Fazendo as contas
Para fazer as contas de quanto o ar esfria-se, você precisa
de duas equações. A equação de estado para um gás ideal é
![]() ,
,
onde P é a
pressão (em N/m2 no
sistema internacional), V é o volume
(m3 no SI), n é o número de moles daquela amostra de
gás, T é a temperatura em K e ![]() . Essa equação vale sempre, desde que o gás não esteja muito
comprimido. Por exemplo, a uma atmosfera (
. Essa equação vale sempre, desde que o gás não esteja muito
comprimido. Por exemplo, a uma atmosfera (![]() ), a 00C,
que equivale a 273 K, um mol de
gás (n=1) ocupa um volume de
), a 00C,
que equivale a 273 K, um mol de
gás (n=1) ocupa um volume de
![]() ,
,
ou seja, 22l.
A
outra equação necessária é a que diz o que ocorre com um gás que não troca
energia com algum outro sistema por causa de uma diferença de temperatura, ou
seja, em linguagem técnica, sofre uma transformação adiabática. Essa equação é
![]() ,
,
onde P, V, P’
e V’ são valores de pressão e volume
ocupados pelo gás em duas situações diferentes. O expoente ![]() depende do tipo de gás
e, no caso do ar, quase totalmente formado de N2 e O2,
vale 1,4. Por exemplo, considere uma amostra de gás a 1 atm que ocupa um volume de 1l. Ao comprimir adiabaticamente (por
exemplo, comprimindo rapidamente uma bomba de encher pneu de bicicleta e cuja
saída de ar tenha sido fechada) esse gás até que ele passe a ocupar um volume
de meio litro, a nova pressão será dada por
depende do tipo de gás
e, no caso do ar, quase totalmente formado de N2 e O2,
vale 1,4. Por exemplo, considere uma amostra de gás a 1 atm que ocupa um volume de 1l. Ao comprimir adiabaticamente (por
exemplo, comprimindo rapidamente uma bomba de encher pneu de bicicleta e cuja
saída de ar tenha sido fechada) esse gás até que ele passe a ocupar um volume
de meio litro, a nova pressão será dada por
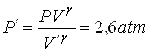 .
.
Para descobrir a temperatura
do gás basta usar a equação de estado...